1. Pt纳米粒子与碳载体的相互作用
Bogotski等认为[2],Pt和C之间形成双电层。Pt(5.4eV)和C(4.7eV)的功函数有所不同,因此导致了Pt的电子密度增加,然而这种增加只会在Pt的尺寸和电双层厚度相近时有显著影响。Kobelev等[3]研究了这种厚度关系,他们认为如果层厚度为0.3nm,Pt纳米粒子为八面体,其边长为a。当a=0.6,1.0,1.5和2.0nm时,双电层体积和所有粒子体积的比例为71,42,28和21%。
XPS则证明金属给碳载体传输电子[1],Pt/C的4f7/2峰相对于Pt的峰发生了右移(图1)。同样小尺寸也会导致吸附能的增加,1-2nm的粒子没有达到正常的连续能带结构,峰右移,半高宽增加。
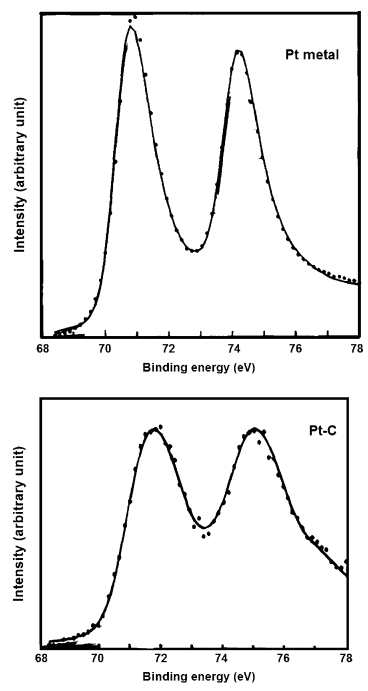
图1 Pt/C与Pt的Pt4f峰
这里有两种观点,从很多现象可以得到电子从Pt转移到碳,但是根据Bogotski的功函数对比结果,Pt纳米粒子的电子密度是增加了的。具体情况需要实验表征确定。
2 Pt前驱体与碳载体的相互作用
2.1 实验研究
XPS是一个有效探究Pt前驱体与碳载体相互作用后价态变化的表征手段。Czaran等[6]发现将H2PtCl6加入碳载体在烘干后Pt以Pt0和Pt2+存在。Van dam等[7]发现氯铂酸注入活性炭后,部分转为Pt2+复合物。碳载体表面的含氧官能团通过TPR和TPD测量,产生CO或CO2气体。也有文献[8]使用EXAFS来分析碳和Pt前驱体的相互作用,发现H2PtCl6与碳的相互作用伴随着Pt的配体从Cl变为O,如图2所示。
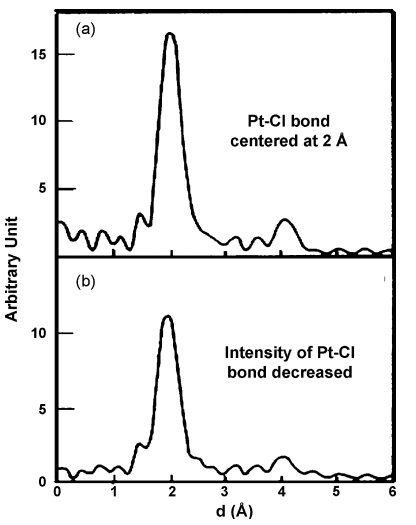
图2 (a) H2PtCl6的EXAFS (b)注入碳载体后。形成Pt-O键后Pt-Cl键的强度减少。
酸性环境中的H2PtCl6和碱性环境中的[Pt(NH3)4]Cl2是Pt/C的主要合成前驱体。
2.2 前驱体与碳载体相互作用模型研究
van dam等[4]认为简单的静电理论不能解释H2PtCl6在碳载体上的吸附过程。他们提出一种H2PtCl6注入到碳载体的模型。首先,碳将Pt(IV)还原到Pt(II),然后Pt(II)化合物被限制在载体上。
(1)
(2)
配位点S认为是π-complex结构或氧表面基团。氧化碳的表面模型应该基于独立的酸和碱基团,它们通过以下平衡公式离子化:
(3)
(4)
其中A和B代表碳固体阵列或者表面氧化基团。因此酸性氧化表面基团应该被认为是弱的锚定点。而碱性的碳表面氧化基团是强的[PtCl6]2-锚定点,是Pt强吸附在碳表面的原因。碳表面位点通常与类吡啶酮结构相关。这种结构有pKb>11(pKb越大,碱性越小),800度以上分解出CO的特点。它们会和表面羧酸基团有强电子相互作用,被表面氧化所损坏。
有其他观点认为表面碱性位点是路易斯型的,并且与平面的富π电子基团相关联。根据Leon等提出的观点[5],这些无氧碱性碳基团的质子化作用会导致形成电子-施主-受主的化合物:
(5)
(6)
Cπ可能是一个π电子对限域石墨碳薄片表面,导致H3O+附着在上面,这是一种碳的碱性表面基团。
Lambert等[9]提出一种可能的PtCl6-的强吸附机理:
(吸附PtCl6-没有被还原的时候) (7)
(吸附的同时发生还原反应) (8)
根据这个模型,配体Cl-会被基团取代。式(7)中会出现水分子配体,式(8)则形成C-O-Pt.
3 处理碳载体表面提高催化剂活性
3.1 氧化处理碳载体
一些通常类型的含氧基团(羧基、酚基、内酯基)如图3所示
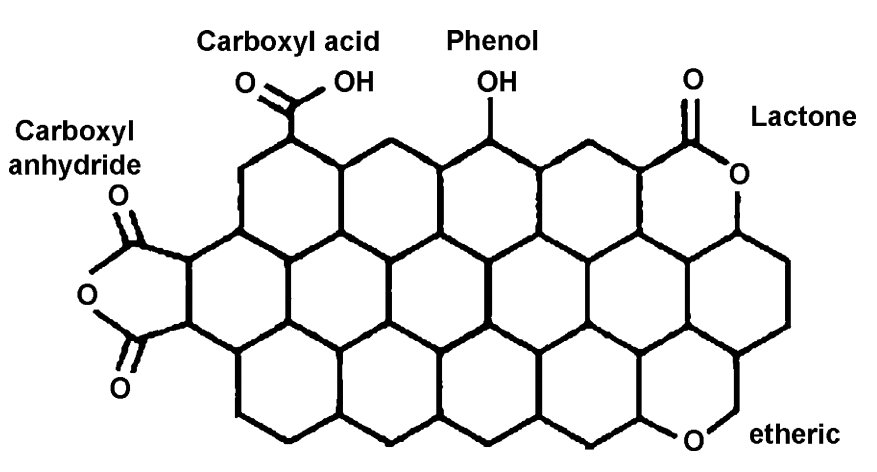
图3 几种碳载体上的含氧官能团
碳载体表面氧化处理会导致酸位点的形成和碱位点的损坏。通常可以通过加入氧化剂进行处理:HNO3, H2SO4, H3PO4, H2O2, O2, O3, KClO3, KMnO4等。形成的酸中心可以降低碳的疏水性,使碳载体更易于与水溶液的金属前驱体接触。图4说明了随着含氧官能团增加、Pt沉淀增加,因此载体疏水性高时一般都要氧化处理。进一步讲,这种酸性含氧基团的引入增强了前驱体或纳米粒子与碳载体的相互作用,并最小化Pt/C的烧结(增强相互作用可以减少烧结的损失)。
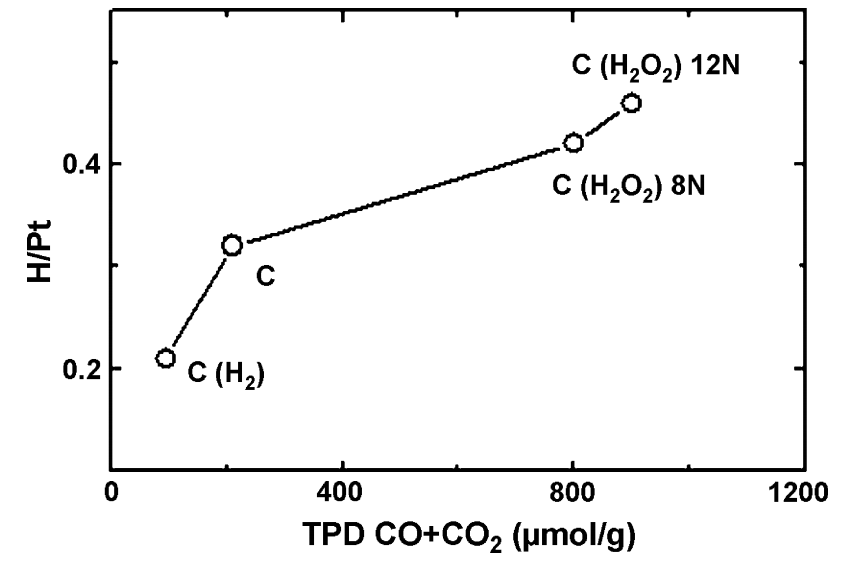
图4 Pt沉淀分布于含氧官能团数,官能团数通过TPD产生的CO数得到。
Torres等[10]认为不同氧化剂处理会得到不同的碳载体。羰基和酸酐(两个羧基连成环)是强酸基团,内酯、酚类和羰基是弱酸基团(含的氧少,电负性弱,酸性弱)。在TPD中释放CO2的是强酸基团,释放CO的是弱酸基团。通过TPD检测发现HNO3处理碳载体得到高浓度的强和弱酸基团,而H2O2和O3处理则是高浓度的弱酸基团和低浓度的强酸基团,而Pt前驱体与H2O2和O3处理的碳载体的相互作用更强。说明相比强酸性含氧官能团,Pt前驱体与弱酸性含氧官能团相互作用更强。
Rodriguez[11]认为
- 碳载体的氧化通常会使碳表面更酸性,因此在很宽的pH范围内带负电(可能是酸性基团的氢离子解离后带负电)。这导致对PtCl62-阴离子的静电排斥,和对[Pt(NH3)4]2+的静电吸引。
- 增加没有氧的碳平面的Cπ位点会最大化吸引阴离子,比如:Cπ-H3O+-PtCl62-。
- C=O作为锚定中心防止团聚和粒子表面扩散。
有一种重要的观点认为在还原过程中,催化剂获得活性相,有一些氧表面基团不稳定,导致金属粒子的烧结。同样氧表面基团可能影响其他碳表面中心,π位点的强度可能因为氧基团吸电子效应而消除。Coloma[12]认为氧基团的出现促进了碳和Pt前驱体的相互作用,但是在高温氢气还原后,大部分不够稳定的氧基团分解了,剩下的影响了离域在π位点的电子,渐弱了它们锚定的能力。
碳载体表面氧化有很多矛盾的观点,有一些学者发现氧表面基团渐弱了载体和金属的相互作用,增加含氧基团会减少会减少碱位点数,削弱PtCl62-的吸附作用[13]。
参考文献
[1] A.K. Shukla, M.K. Ravikumar, A. Roy, S.R. Barman, D.D. Sarma, A.S.
Arico, V. Antonucci, L. Pino, N. Giordano, J. Electrochem. Soc. 141 `
(1994) 1517.
[2] V.S. Bogotski, A.M. Snudkin, Electrochim. Acta 29 (5) (1984) 757.
[3] A.V. Kobelev, R.M. Kobeleva, V.F. Ukhov, Dokl. Akad. Nank. (USSR)
243 (1978) 692.
[4] H. Van dam, H. Van Bekkum, J. Catal. 131 (1991) 335.
[5] C. Leon, Y. Leon, J. Solar, V. Calemma, L. Radovic, Carbon 30 (1992)
[6] E. Czaran, J. Finster, K. Schnabel, Z. Anorg. Allg. Chem. 443 (1978) 175.
[7] H. Van dam, H. Van Bekkum, J. Catal. 131 (1991) 335.
[8] S. De Miguel, O. Scelza, M. Romanmartinez, C. Salinas-Martinez, D.
Cazorlaamoros, A. Linares-Solano, Appl. Catal. A 170 (1998) 93.
[9] J. Lambert, M. Che, J. Mol. Catal. A 162 (2000) 5.
[10] G. Torres, E. Iablonski, G. Baronetti, A. Castro, S. De Miguel, O. Scelza, M. Blanco, M. Pena Jimenez, J. Fierro, Appl. Catal. A 161 (1997) 213.
[11] F. Rodriguez-Reinoso, Carbon 36 (1998) 159.
[12] F. Coloma, A. Sepulveda-Escribano, J. Fierro, F. Rodriguez-Reinoso,
Langmuir 10 (1994) 750.
[13] A. Guerriero-Ruiz, P. Badenes, I. Rodriguez-Ramos, Appl. Catal. A 173
(1998) 313.