在单原子催化剂制备中如何稳定单原子是一个很重要的问题。一些使单原子稳定的方式:可还原的氧化物(比如TiO2和CeO2)和石墨烯或C3N4上的缺陷有助于金属原子在载体上的稳定。Al2O3中的不饱和Al3+可以是键位中心来维持Pt原子的高分散。
文献[1]使用一种室温光催化的策略来制备高稳定性,原子级分散的Pd/TiO2纳米片催化剂,Pd载量达到1.5%。催化剂在C=C和C=O的氢化作用上有很高的催化活性和稳定性。
催化剂制备
首先通过TiCl4和乙二醇的水热反应制备了乙二醇覆盖超薄TiO2纳米片(两个原子层厚),XRD证实为典型的TiO2晶型,使用了Rietveld refinement计算出晶格常数。
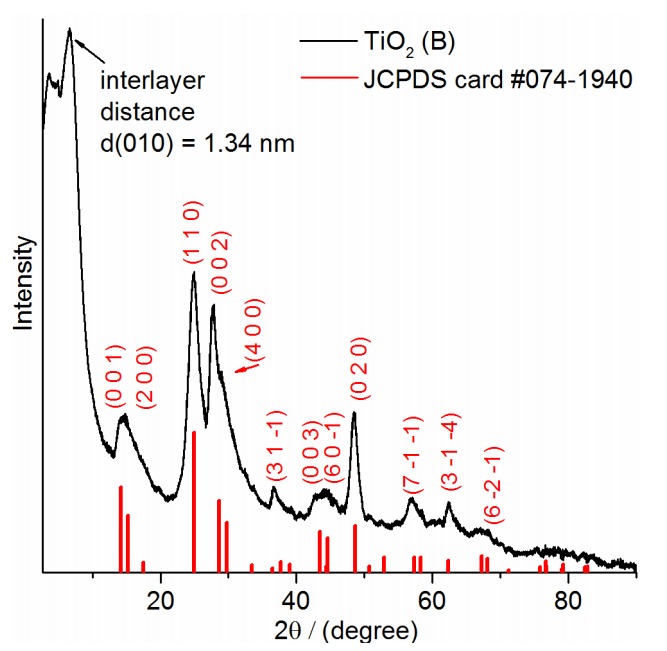
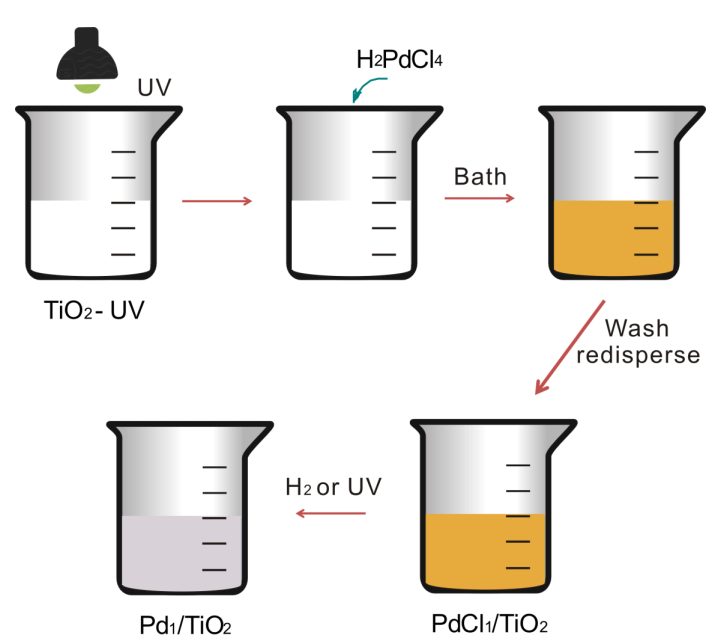
然后加入H2PdCl4前驱体到分散了TiO2的水溶液中,先让Pd吸附在纳米片上。TiO2的zeta电势随pH值发生改变。当加入H2PdCl4时,溶液为酸性,[PdCl4]2-可以靠静电作用吸附在zeta电势为正的TiO2表面。(测量时将纳米片分散在不同pH值的溶液内,用zeasizer测量)
在Pd吸附在TiO2表面后,用紫外灯对样品溶液照射10min。之后用TEM观察发现没有Pd纳米粒子出现,即使使用ICP测量发现Pd载量达到1.5%时都没有纳米粒子出现。
实验表征
通过EXAFS谱发现几乎没有Pd-Pd键峰,只有一个很明显的Pd-O键峰,同时XANES谱图也证明近边结构更接近于PdO,Pd为氧化价态。
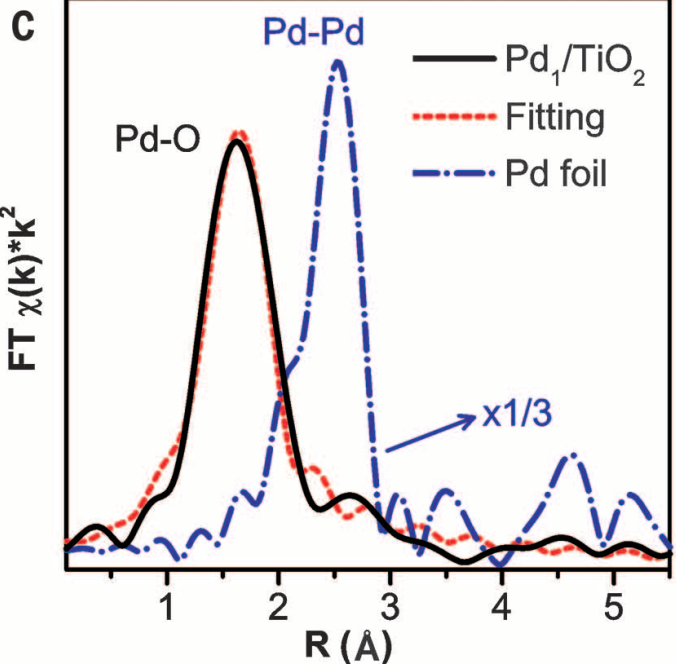
在350度煅烧去除有机物后,仍然有大量Pd单原子存在。

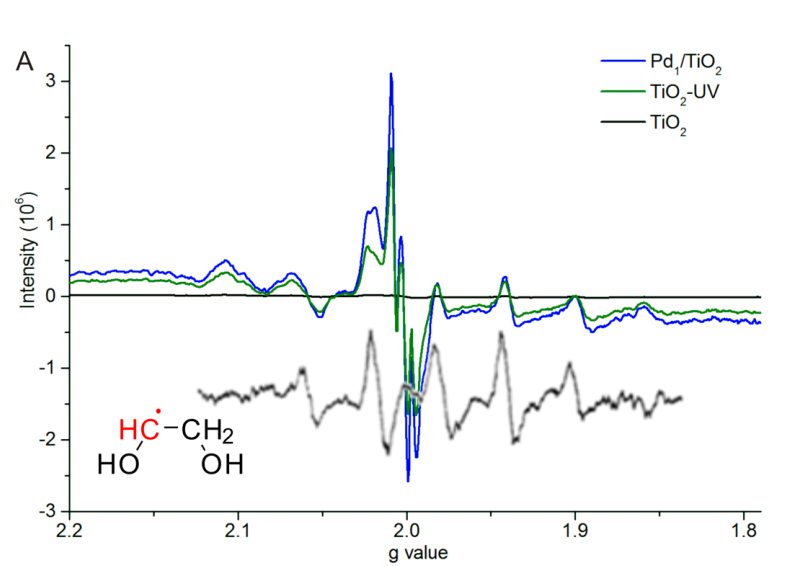
实验证明紫外线照射对Pd上Cl-,使用紫外线对PdCl2/TiO2照射10min后,Cl-全部被脱除到溶液中。该现归因于TiO2的光催化。单独对TiO2纳米片进行紫外线照射,之后进行测量,发现电子自选共振谱(ESR)中,发现很明显的Ti3+物种峰和对应乙二醇自由基(HOCH2CHOH)的六个峰。在Pd/TiO2上同样可以得到乙二醇自由基和Ti3+说明在紫外照射后Ti4+得到一个电子,并且纳米片表面形成乙二醇自由基。乙二醇自由基在C上有个单电子。
原理探索
根据光照前后的结果,文中认为是紫外线照射下TiO2产生一对电子空穴对,电子固定在Ti-3d轨道中形成Ti3+,空穴断开了乙二醇和TiO2之间的Ti-O键,形成自由基(-OCH2CH2O),并且这种自由基足够稳定。
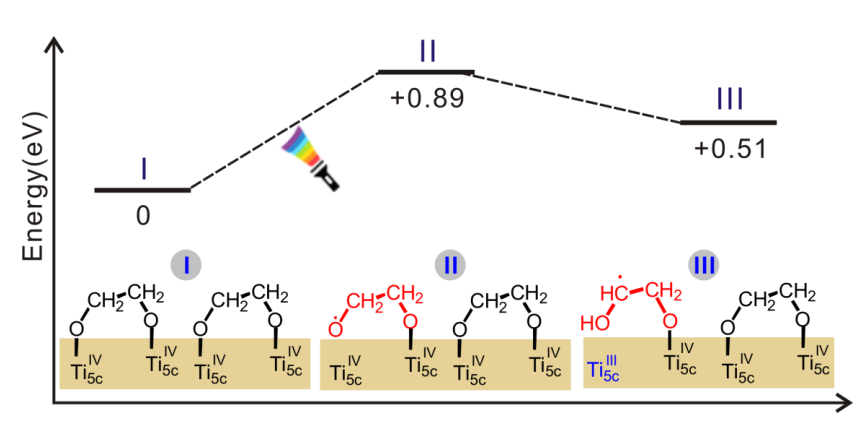
之后文章研究了乙二醇自由基是如何促进[PdCl4]2-中的Cl-去除的,文中设计了一个实验,先对纳米片光照再放H2PdCl4,之后在进行紫外光照和H2处理。
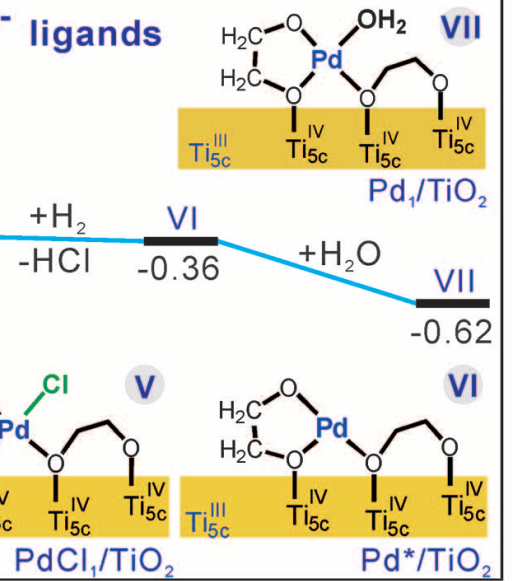
在紫外光照后TiO2纳米片表面有乙二醇自由基。计算表明[PdCl4]2-一旦吸附在TiO2表面后就会释放两个Cl-基团,因此有PdCl2中间体,同时Pd会和两个O成键。
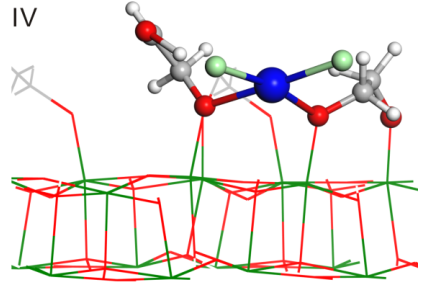
(红色为O,绿色Cl,蓝色Pd,灰色C,白色H)
之后,乙二醇自由基的羟基OH进攻Pd位点并取代一个Cl-,导致PdCl1/TiO2中间体的形成。
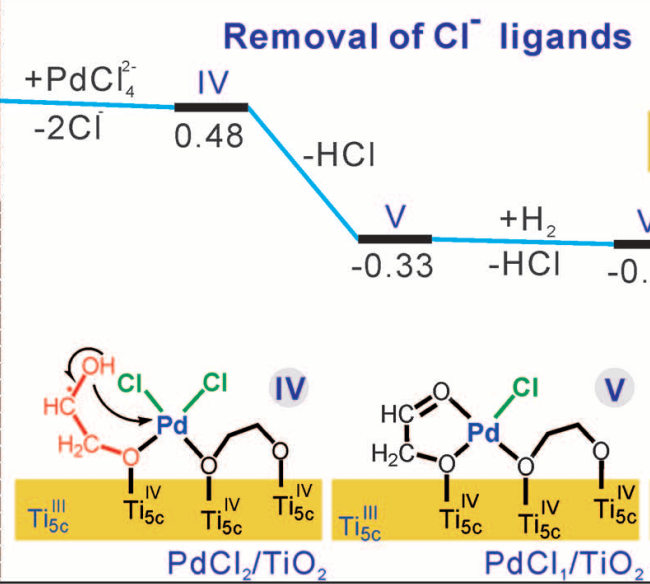
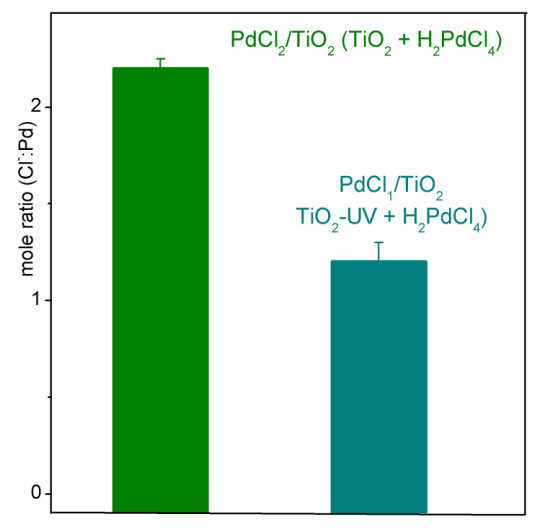
除了理论计算,文中也使用了多种实验结果来验证这个结果。实验对比了标准实验光照之前的PdCl2/TiO2和先光照TiO2的PdCl1/TiO2的Pd:Cl比值。其中Cl数量由莫尔滴定法获得,Pd数量由ICP-MS获得。发现Pd:Cl比值从2:1下降到1:1。EXAFS也发现PdCl1/TiO2中Pd-O和Pd-Cl的配位数分别为3.1和1.1,同样验证了实验结果。
根据计算和实验结果结合可以得出乙二醇自由基确实起到去除Pd上的Cl-的能力。之后通入H2很容易去除PdCl1/TiO2中剩下的Cl-,生成H+和Cl-。水洗后H2O分子也会吸附在Pd原子上。
总结
文献[1]对制备过程的原理解释得非常的详细,首先TiO2靠静电作用吸附带负点的[PdCl4]2-,之后在光照下TiO2光催化产生乙二醇自由基,[PdCl4]2-吸附在O上后丢失两个Cl。之后很重要的一步是乙二醇自由基的羟基氧再取代一个Cl,这个非常重要的实验现象通过理论计算和各种表征手段共同验证。最终氢处理和水洗后得到稳定高分散的Pd单原子催化剂。
参考文献
[1] Liu P, Zhao Y, Qin R, et al. Photochemical route for synthesizing atomically dispersed palladium catalysts[J]. Science, 2016, 352(6287): 797-800.