1 XPS基本原理
在原子中电子的轨道运动能量状态是不连续的,一般表征其性质由主量子数、角量子数、自旋量子数、总量字数等表示。当电子处于某特定轨道运动时,给电子能量比如一个能量足够高的光子,电子可以被激发到更高能量的轨道位置甚至脱离原子的束缚变成自由光电子。XPS的基本原理就是用X射线激发电子成光电子之后测量光电子的动能。
1.1 结合能EB
当光子动能hv足够大时,就可以激发动能为EK的光电子:
A + hv -> A* + e-
根据电离守恒:
Ei(n) + hv = Ef(n-1, k) + EK
定义结合能为:EB = Ef(n-1, k) - Ei(n),表示为原子有无该电子时的能量差。
得到爱因斯坦光电发射定律:EK = hv - EB
可以通过入射光子能量减去光电子动能得到结合能。
介绍一些结合能的重要性质:
- 要激发出光电子,光子能量要大于结合能与功函数(定义为真空中静止电子能量和费米能级处电子能量的差)的和。所以我觉得结合能可以简单粗暴地理解为费米能级和轨道能级的差。
- 每一种元素都有特定的电子排布(唯一一套芯能级排布),得到的结合能图谱可以用作元素的指纹。
- 元素质子数增加时,轨道结合能增加
- 轨道结合能不受同位素影响
1.2 化学位移
XPS图谱一般是元素某轨道结合能与强度关系图,如图1是Ti和TiO2中Ti元素2p轨道,可以发现两个曲线都有两个主要的峰,而Ti的两个峰相对于TiO2的两个峰发生了整体位移。说明Ti固体的Ti2p轨道结合能相对于TiO2的Ti2p轨道结合能有相对移动。该现象可以通过化学位移解释。化学位移定义为:原子因所处化学环境不同(化合物结构的变化和元素氧化状态的变化)而引起的内壳层电子结合能变化,在谱图上
表现为谱峰有规律的位移,这种现象即为化学位移 。
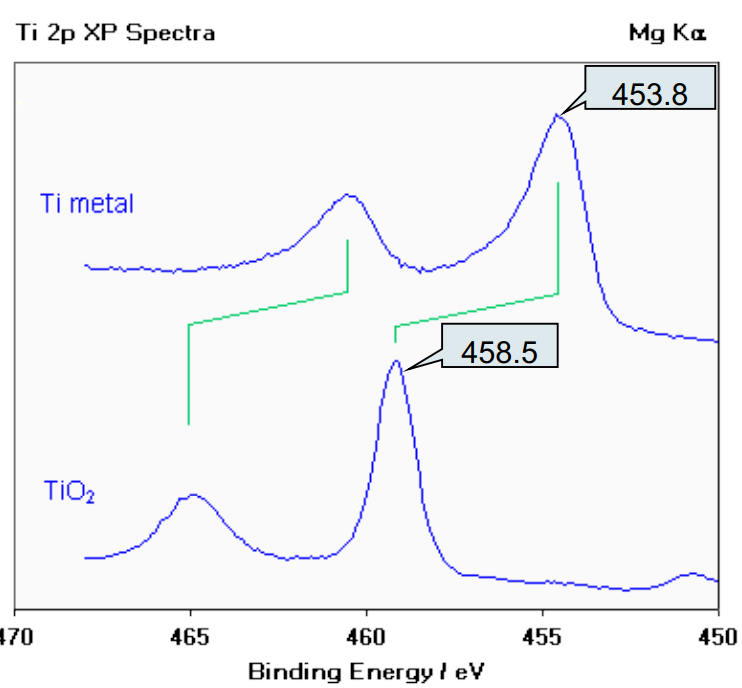
图1 Ti和TiO2中Ti元素2p轨道
指纹
化学位移